应用纳米材料的医疗器械安全性和有效性评价指导原则第三部分生物相容性毒理学评价(2024年第23号)
本指导原则为注册申请人/监管人员提供关于应用纳米材料的医疗器械生物相容性/毒理学评价相关方面的信息。
本指导原则是对应用纳米材料的医疗器械生物相容性/毒理学评价的一般要求,注册申请人应依据具体产品的特性对注册申报资料的内容进行充分说明和细化。注册申请人还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需详细阐述理由及相应的科学依据。
本指导原则是对注册申请人和审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能满足相关法规要求的其它方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、适用范围
本指导原则适用于与人体直接或间接接触,由纳米材料组成或包含纳米材料的医疗器械的生物相容性/毒理学评价。
不适用于:
- 应用纳米材料的体外诊断(In Vitro Diagnosis,IVD)产品;
- 应用纳米材料的赋能技术(如纳米机器人);
- 应用纳米材料的药品;
- 应用纳米材料的医疗器械在制造和废弃过程中造成的职业和环境风险。
二、医疗器械中与纳米材料相关的风险识别和风险评估的层级评价方法
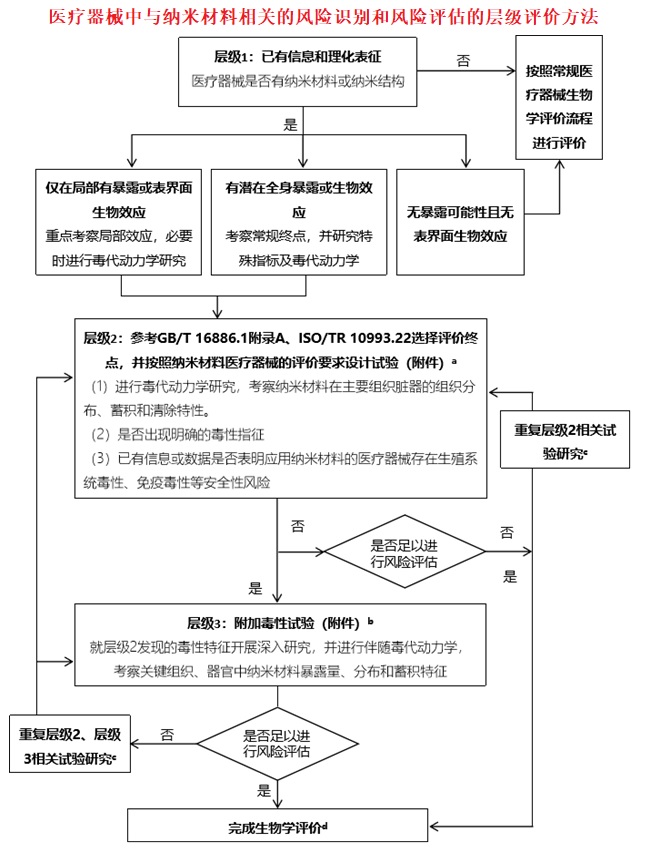
本指导原则描述的应用纳米材料的医疗器械,是指注册申请人在医疗器械产品中应用了纳米材料,且该纳米材料被设计为发挥预期功能。此类医疗器械的生物学评价应首先执行GB/T 16886系列标准文件及医疗器械法律法规的内容,再结合本指导原则描述的纳米材料特殊考虑点进行相关研究。纳米材料的安全风险与常规材料不同,主要取决于纳米材料的化学成分、物理化学性质、纳米特性、纳米结构与形貌、与组织相互作用方式以及暴露途径与水平等。相比于常规材料,纳米材料在样品制备时会有溶解性和分散性的区别,以及稳定性和均一性的要求,因此可能需要考虑纳米材料在样品制备时的特殊性;由于纳米颗粒被认为可能穿越所有生物屏障,包括血脑屏障和胎盘屏障等,因此可能需要考虑纳米材料的全身毒性,特别是中枢神经系统毒性和生殖/发育毒性;“纳米蛋白冠”的形成,可能会影响其生物响应、动力学、蓄积和毒性等生理效应;有些纳米材料具有类佐剂特性,可能会对免疫系统产生影响,需要关注免疫毒性;纳米材料被单核吞噬细胞系统清除、在特定组织器官分布、形成“纳米蛋白冠”等,可能改变其毒代动力学特征。因此,应用纳米材料的医疗器械生物学评价内容,在兼顾GB/T 16886系列标准文件中关于常规器械评价内容的基础上,重点考虑与纳米材料有关的其他问题,如样品制备,吸收、分布、代谢和排泄/清除(ADME)、中枢神经系统毒性和免疫毒性等。对应用纳米材料的医疗器械进行生物相容性/毒理学评价时,需根据GB/T 16886.1附录A中描述的生物学评价框架开展评价,并参考GB/Z 16886.22、本指导原则第三章及附件一中所描述的纳米材料特殊考虑点设计研究/试验方案。
在对应用纳米材料的医疗器械进行生物学评价时,如果纳米材料吸收和分布导致纳米材料的内部暴露、反应活性、代谢动力学或生物持久性发生改变时,可能触发进一步的试验,用于研究非常规的评价终点(如中枢神经系统、免疫系统功能终点)。
为了生成有效的毒理学数据用于应用纳米材料的医疗器械的风险识别和风险评估,更加高效地识别和评价特定风险,本指导原则提供了层级研究方法,用于逐步对应用纳米材料的医疗器械中与纳米材料相关的安全风险开展识别和评估。
层级1:注册申请人应根据医疗器械已有信息(GB/T 16886.1)和理化表征结果判断终产品中是否有纳米材料,若判断无纳米材料,则按照常规医疗器械的生物相容性/毒理学评价研究流程进行;若判断有纳米材料,则收集纳米材料的暴露可能性、表界面生物效应等信息,必要时开展纳米材料脱落和释放研究(参见本系列指导原则第二部分:理化表征)、与接触部位的表界面生物效应研究。基于所收集信息,可参考以下路径进行应用纳米材料的医疗器械的生物相容性/毒理学评价:
(1)若无纳米材料暴露可能性且接触部位无纳米材料相关的表界面生物效应,则按照常规医疗器械的生物相容性/毒理学评价研究流程进行;
(2)若缺乏评估纳米材料暴露的可能性的方法,或难以排除暴露可能性,或试验结果证明有暴露可能性,则进行层级2的研究。
(3)若接触部位存在与纳米材料相关的表界面生物效应,则进行层级2的研究。
基于当前科学技术水平和认知,评估应用纳米材料的医疗器械中纳米材料暴露可能性和与接触部位表界面生物效应的评价方法和技术手段还不够完善,鼓励注册申请人根据应用纳米材料的医疗器械的特性,基于个案处理原则对纳米材料的脱落和释放、与接触部位的表界面生物效应进行研究,保证试验方法、检测技术等因素的可靠性,并持续更新。
层级2:对于仅在接触部位有暴露或生物效应的应用纳米材料的医疗器械,主要考察与局部效应相关的试验终点,必要时进行毒代动力学研究,考察局部组织分布特征,还应关注纳米材料向引流淋巴结迁移及进入血液引发全身效应的风险;对于有潜在全身暴露或全身效应的应用纳米材料的医疗器械,主要针对常规评价终点进行研究/试验,同时增加特殊指标的检测,考察是否有潜在的特殊毒性风险,如免疫毒性、中枢神经系统毒性等,并进行毒代动力学研究,考察主要组织器官的分布、蓄积和清除特性,来决定是否有必要进行深入研究。
层级2的步骤如下:参考GB/T 16886.1附录A选择评价终点,并按照应用纳米材料的医疗器械评价要求设计试验,具体参见本指导原则附件一。GB/T 16886.1附录A列出了一个制定生物学评价的框架,除适用于常规医疗器械外,也适用于应用纳米材料的医疗器械。但由于纳米材料或纳米结构可能引发非预期的生物学效应,若已有信息或数据证明应用纳米材料的医疗器械在某些生物学评价终点有额外的安全风险考虑点,可在层级2开展相关研究。因此,注册申请人应结合纳米材料的纳米特性及暴露特征,基于个案处理的原则,提供评价终点选择的理由,并阐述评价终点选择的科学性和合理性。
以下内容为纳米材料生物相容性与常规材料生物相容性研究差异性的举例,具体内容详见附件一:
细胞毒性:根据细胞摄取纳米材料的能力,以及纳米材料与细胞的相互作用模式考虑需增加的试验。采用合适的细胞来测试纳米材料在靶器官、接触部位细胞、免疫细胞的摄取及生物效应,如肝、肾为潜在靶器官时,可选择HepG2人源肝癌细胞、LLC-PK1猪肾近曲小管细胞等进行试验。
致敏反应:若纳米材料具备一定的透皮性或局部反应风险,仅进行GPMT试验不足以评价纳米材料的致敏反应,可考虑增加体外替代方法并验证方法的适用性,如直接肽反应性测定法(DPRA)、人细胞系激活试验(H-CLAT)、KeratinoSens和SenCeeTox等方法。
亚慢性全身毒性:该试验建议增加附加毒性终点相关检测指标,如生殖系统毒性、中枢神经系统毒性、免疫毒性、内分泌系统毒性等终点的相关敏感指标的检测。
慢性毒性、致癌性、生殖/发育毒性、中枢神经系统毒性、免疫毒性、内分泌干扰等附加毒性终点一般不作为层级2的首批评价终点,但需在层级2的其他试验中增加与上述终点相关的敏感指标的检测,作为是否进入层级3的依据,如在亚慢性全身毒性试验中增加中枢神经系统的功能观察组合指标的检测,考察应用纳米材料的医疗器械是否有潜在中枢神经系统毒性。
若层级2的研究结果未发现附加毒性终点相关毒性指征的改变,一般无需进入层级3的研究,而是考察层级2的研究结果是否足以进行生物相容性/毒理学风险评估,若研究结果不足以进行生物相容性/毒理学风险评估,则需修正试验条件重复层级2相关研究内容,直至完成生物学评价,或根据研究结果停止生物学评价研究。
若层级2研究结果提示明确的附加毒性终点相关毒性指征,则进入层级3的研究。这些毒性指征包括但不限于纳米材料存在消除缓慢、在特定的组织器官内有蓄积的潜力、需要更长时间的代谢数据,或毒性特征提示需要关注特定组织/器官的毒性等。此外,若已有信息或数据证明应用纳米材料的医疗器械存在生殖系统毒性、免疫毒性等安全性风险时,可考虑直接进行层级3的相关研究。
层级3:是对层级2中发现的应用纳米材料的医疗器械附加毒性终点相关毒性指征发生明显改变时,开展与毒性指征相对应的全面的特殊试验,如生殖/发育毒性试验、致癌性试验、免疫毒性试验、中枢神经系统毒性试验、或内分泌干扰试验等,参见本指导原则附件一,同时伴随相应试验开展毒代动力学研究,考察所关注的特殊组织器官中纳米材料暴露、分布和蓄积特征。注册申请人应结合纳米材料的纳米特性及暴露特征,基于个案处理的原则,提供评价终点选择的理由,并阐述评价终点选择的科学性和合理性。
完成层级3的研究后,结合层级2和层级3的研究结果考察是否足以进行生物相容性/毒理学风险评估。若层级2、层级3的研究结果足以进行生物相容性/毒理学风险评估,不必再进行其他试验;否则应重复层级2或层级3的相应研究内容,直至完成生物学评价,或根据研究结果停止生物学评价研究。
由于文章篇幅限制,本文并为列出《应用纳米材料的医疗器械安全性和有效性评价指导原则第三部分生物相容性毒理学评价》全部内容,如需完整内容,可以随时方便与检验员培训网联络,联系人:吕工,电话:18868735317,微信同。